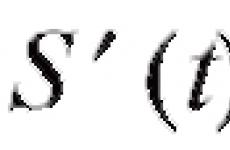Cadrul legislativ al Federației Ruse. Cadrul legislativ al Federației Ruse 916 Legea Ministerului Industriei și Comerțului intrarea în vigoare
nu a intrat în vigoare Editorial din 14.06.2013
| Numele documentului | ORDIN al Ministerului Industriei și Comerțului al Federației Ruse din 14 iunie 2013 N 916 „PRIVĂ APROBAREA REGULUI DE ORGANIZAREA PRODUCȚIEI ȘI CONTROLULUI CALITĂȚII MEDICAMENTELOR” |
| Tip document | ordine, reguli |
| Autoritatea de primire | Ministerul Industriei și Comerțului al Federației Ruse |
| Numărul documentului | 916 |
| Data acceptarii | 01.01.1970 |
| Data revizuirii | 14.06.2013 |
| Număr de înregistrare în Ministerul Justiției | 29938 |
| Data înregistrării la Ministerul Justiției | 10.09.2013 |
| Stare | nu a intrat în vigoare |
| Publicare |
|
| Navigator | Note |
ORDIN al Ministerului Industriei și Comerțului al Federației Ruse din 14 iunie 2013 N 916 „PRIVĂ APROBAREA REGULUI DE ORGANIZAREA PRODUCȚIEI ȘI CONTROLULUI CALITĂȚII MEDICAMENTELOR”
Anexa 1. PRODUCEREA MEDICAMENTELOR STERILE
I. PRINCIPIUL
1. La producerea de steril medicamente Sunt necesare cerințe speciale pentru a minimiza riscul de contaminare cu microorganisme, particule și pirogeni. Aceste prevederi depind de calificarea personalului de producție, de pregătirea acestora și de atitudinea față de muncă. Pentru a asigura calitatea, producția de produse sterile necesită respectarea metodelor și procedurilor de fabricație atent dezvoltate și validate. Etapa finală de producție sau control produse finite nu sunt singurele mijloace de asigurare a sterilității sau alți indicatori ai calității produsului.
2. Metodele detaliate pentru determinarea curățeniei aerului, suprafețelor și altor obiecte de monitorizare pentru microorganisme și particule sunt determinate de standardele de reglementare acte juridice Federația Rusă.
II. CERINȚE GENERALE3. (1) Produsele sterile trebuie să fie produse în spații curate, accesul personalului la care și (sau) intrarea echipamentelor, materiilor prime și materialelor de ambalare trebuie să se facă prin ecluze. Camerele (zonele) curate trebuie menținute la un nivel de curățenie care să îndeplinească nivelul corespunzător de curățenie și trebuie să fie alimentate cu aer care a trecut prin filtre de eficiență corespunzătoare.
4. (2) Diverse operațiuni de pregătire a componentelor, pregătire a produsului și umplere trebuie efectuate în zone separate din zona curată. Operațiile tehnologice se împart în două categorii: prima, când produsul este supus sterilizării finale (în ambalaj primar), iar a doua, când operațiunile în mai multe sau toate etapele sunt efectuate în condiții aseptice.
5. (3) Spaţiile (încăperile) curate pentru producerea produselor sterile se clasifică în conformitate cu caracteristicile cerute ale mediului de producţie. Fiecare operațiune de producție necesită un anumit nivel de curățenie a mediului de producție în starea de funcționare pentru a minimiza riscul de contaminare cu particule sau microorganisme a produsului sau a materiilor prime și materialelor prelucrate.
6. Pentru a asigura conformitatea în starea „operată”, zonele curate trebuie proiectate astfel încât să asigure un nivel specificat de curățenie a aerului în starea „echipată”.
7. Starea „Echipată” - starea în care este construită și funcționează camera curată, echipamente tehnologice cu personal complet, dar fără personal.
8. Starea „de funcționare” este o stare în care camera curată și echipamentul de proces funcționează în modul necesar cu un număr dat de personal de lucru.
9. Pentru fiecare cameră curată sau complex de camere curate ar trebui stabilite cerințe pentru stările „echipate” și „de funcționare”.
10. Zonele curate (spațiile) în producția de medicamente sterile sunt împărțite în patru clase:
Clasa A este o zonă locală de desfășurare a operațiunilor care prezintă un risc ridicat pentru calitatea produsului, în special zonele de umplere și închidere, zone în care fiolele și flacoanele sunt deschise și conexiunile pieselor echipamentelor sunt realizate în condiții aseptice. De regulă, astfel de condiții sunt asigurate de fluxul de aer laminar la locul de muncă. Sistemele cu flux de aer laminar trebuie să asigure o viteză uniformă a aerului în intervalul 0,36 - 0,54 m/s (valoare standard) pe suprafața de lucru situată într-o zonă deschisă, curată. Menținerea laminarității trebuie dovedită și validată. În izolatoarele închise și torpedoul, este permis fluxul de aer unidirecțional la viteze mai mici;
Clasa B este zona care înconjoară imediat zona de clasă A destinată pregătirii și umplerii aseptice;
Clasele C și D sunt zone curate pentru pași mai puțin critici în producția de produse sterile.
III. CLASIFICAREA CAMERELOR CURATE ȘI A ZONELOR CURATE11. (4) Camerele curate și zonele curate sunt clasificate<*>. Confirmarea clasei de curățenie trebuie să fie clar separată de monitorizarea mediului de proces. Concentrația maximă admisă de particule de aerosoli pentru fiecare clasă este dată în Tabelul nr. 1.
Tabelul nr. 1
| Zonă | Numărul maxim admis de particule într-un metru cub. m de aer cu o dimensiune a particulei egală sau mai mare | |||
| In stare de functionare | ||||
| 5,0 µm | 0,5 µm | 5,0 µm | ||
| O | 3 520 | 20 | 3 520 | 20 |
| B | 3 520 | 29 | 352 000 | 2 900 |
| C | 352 000 | 2 900 | 3 520 000 | 29 000 |
| D | 3 520 000 | 29 000 | Nereglementat | Nereglementat |
12. (5) În scopul clasificării în zonele de clasa A, volumul minim de aer prelevat nu trebuie să fie mai mic de 1 m3 pentru fiecare punct de prelevare. Clasa A corespunde clasei ISO 4.8 pentru limita de particule în aer de 5,0 microni.
Clasa B (dacă este echipată) pentru particule de aerosoli corespunde clasei ISO 5 pentru ambele dimensiuni specificate ale particulelor.
Clasa C (în condiții de echipare și de funcționare) în ceea ce privește numărul de particule de aerosoli corespunde clasei ISO 7 și, respectiv, ISO 8.
Clasa D (în stare echipată) corespunde clasei ISO 8 în ceea ce privește numărul de particule de aerosoli.
Pentru a confirma clasa de puritate, se folosește o tehnică<*>, care reglementează atât numărul minim de puncte de prelevare, cât și volumul probei, ținând cont de limitele unei clase date pentru numărul de particule de cea mai mare dimensiune specificată, precum și de metoda de evaluare a datelor obținute.
<*>Pentru referință: GOST R ISO 14644-1 (EN ISO 14644-1).
13. (6) Contoarele portabile de particule cu tuburi scurte de prelevare trebuie utilizate pentru verificarea clasei, din cauza ratelor relativ mari de depunere a particulelor de 5,0 µm în sistemele de prelevare la distanță cu tuburi lungi. Pentru sistemele de flux de aer unidirecționale, trebuie utilizate duze izocinetice de prelevare de probe.
14. (7) Confirmarea clasei în starea de funcționare poate fi efectuată în timpul funcționării sau la simularea operațiunilor de lucru sau la umplerea cu medii nutritive, după cum se cere prin modelarea situației în care sunt simulați parametrii de funcționare maximi admisibili. proces tehnologicîn factorii și condițiile cele mai nefavorabile (denumite în continuare cel mai rău caz)<*>.
<*>Pentru referință: Instrucțiunile pentru efectuarea testelor pentru a confirma conformitatea continuă cu o anumită clasă de curățenie sunt date în standardul GOST R ISO 14644-2 (EN ISO 14644-2).
IV. MONITORIZARE CAMERE CURATE SI ZONE CURATE15. (8) Este necesar să se efectueze o monitorizare continuă a camerelor curate și a zonelor curate în timpul funcționării acestora. Punctele de prelevare pentru monitorizarea de rutină sunt selectate pe baza analizei de risc și a rezultatelor obținute din clasificarea camerelor curate și/sau a zonelor curate.
16. (9) Pentru zonele de clasa A, monitorizarea particulelor trebuie efectuată continuu pe parcursul procesului critic, inclusiv asamblarea echipamentelor. Sub rezerva justificării adecvate, se face o excepție pentru procesele care implică contaminanți care ar putea deteriora contorul de particule sau pot prezenta un pericol, cum ar fi organismele vii sau pericolele radiologice. În astfel de cazuri, monitorizarea ar trebui efectuată în timpul operațiunilor normale de configurare a echipamentului până când apare un risc. De asemenea, este necesar să se efectueze monitorizarea în timpul simulărilor de funcționare. În zonele de Clasa A, monitorizarea ar trebui efectuată la o astfel de frecvență și volum de eșantioane încât să poată fi înregistrate toate intervențiile, evenimentele accidentale și orice deteriorare a sistemului, iar dacă limita de avertizare este depășită, se poate declanșa o alarmă. Direct la punctul de umplere, nu este întotdeauna posibil să se demonstreze niveluri scăzute de particule de 5,0 µm în timpul procesului de umplere din cauza formării de particule sau picături din produsul însuși.
17. (10) Se recomandă utilizarea aceluiași sistem pentru zonele de clasă B, deși frecvența prelevării poate fi mai mică. Importanța unui sistem de monitorizare a particulelor ar trebui să fie determinată de eficacitatea separării dintre zonele adiacente de clasă A și B. În zonele de clasă B, monitorizarea ar trebui să fie efectuată la o astfel de frecvență și volum de eșantionare adecvat care se modifică în nivelul de contaminare și. orice deteriorare a performanței sistemului poate fi înregistrată, iar în cazul în care nivelul de alarmă este depășit, se pot lua măsuri de urgență.
18. (11) Sistemele de monitorizare a particulelor de aerosoli pot consta din contoare independente de particule, un sistem de puncte de prelevare secvenţiale conectate la un singur contor de particule sau o combinaţie a acestor două abordări. Cerințele privind dimensiunea particulelor trebuie luate în considerare la selectarea sistemelor de control. Când se utilizează sisteme de eșantionare la distanță, trebuie luată în considerare lungimea tubulaturii și razele curbelor tubulaturii pentru a ține cont de posibilitatea depunerii particulelor în tubulatura. La alegerea unui sistem de monitorizare, este de asemenea necesar să se țină cont de orice risc pe care îl prezintă materialele utilizate în proces, cum ar fi prezența microorganismelor vii sau a substanțelor radioactive. medicamente.
19. (12) Când se utilizează sistem automatizat Pentru monitorizarea continuă, volumul eșantionului depinde de obicei de rata de eșantionare a sistemului utilizat. Volumul probelor în timpul monitorizării de rutină poate diferi de volumul probelor în timpul calificării camerelor curate și zonelor curate.
20. (13) În zonele de clasă A și B, monitorizarea concentrației de particule de 5,0 µm are sens special, deoarece este un instrument de diagnostic important pentru depistarea precoce a neconformității. Ocazional, numărul de particule de 5,0 microni poate fi eronat din cauza zgomotului electronic, a luminii străine, a evenimentelor aleatorii și a altor factori. Cu toate acestea, dacă contorul înregistrează în mod constant și sistematic un număr mic de particule, aceasta indică posibilitatea contaminării, ceea ce necesită investigație. Astfel de cazuri pot indica în prealabil o defecțiune a sistemului de ventilație și aer condiționat, instalația de umplere sau pot indica o încălcare a regulilor în timpul instalării sau funcționării echipamentului.
21. (14) Cantitate acceptabila particulele pentru starea echipată indicată în tabel trebuie atinse după o perioadă scurtă de curățare de 15 - 20 de minute (valoare standard) în absența personalului după terminarea lucrărilor.
22. (15) Monitorizarea zonelor de clasă C și D aflate în stare operațională se efectuează în conformitate cu principiile managementului riscului de calitate. Nivelul de alarmă și cerințele nivelului de acțiune vor depinde de natura operațiunilor efectuate, dar în toate cazurile trebuie atinsă valoarea recomandată pentru „perioada de curățare”.
23. (16) Alți indicatori, precum temperatura și umiditatea relativă, depind de produs și de natura operațiunilor efectuate. Acești parametri nu ar trebui să afecteze standardele de curățenie stabilite.
24. (17) Exemple de operațiuni care ar trebui efectuate în zone cu diferite clase de curățenie sunt date în Tabelul nr. 2, precum și în paragrafele 35 - 42 din prezentul Anex.
Tabelul nr. 2
25. (18) Atunci când se efectuează procese aseptice, monitorizarea microbiologică trebuie efectuată în mod continuu folosind metode de prelevare de probe prin sedimentare și aspirație, prelevarea de probe de suprafață folosind tampoane și plăci de contact. Metodele de eșantionare utilizate în timpul funcționării nu trebuie să dăuneze protecției zonei. Rezultatele monitorizării ar trebui să fie luate în considerare la revizuirea dosarului lotului pentru eliberarea permisului de eliberare a produsului finit. După operațiuni critice, suprafețele și personalul trebuie monitorizate. De asemenea, ar trebui efectuată monitorizare microbiologică suplimentară în afara procesului, în special după validarea sistemului, curățarea și dezinfecția.
Tabelul nr. 3
| Clasă | Limitele recomandate pentru contaminarea microbiană (a) | |||
| Sedimentare pe vas cu diametrul de 90 mm, CFU în 4 ore (b) | Plăci de contact cu diametrul de 55 mm, CFU/placă | Amprentă mănușă (5 degete), CFU/mănușă | ||
| O | < 1 | < 1 | < 1 | < 1 |
| B | 10 | 5 | 5 | 5 |
| C | 100 | 50 | 25 | - |
| D | 200 | 100 | 50 | - |
| Nota: (a) Sunt afișate valorile medii. (b) Plăcile de sedimentare individuale pot fi expuse mai puțin de 4 ore. |
||||
27. (20) Pe baza rezultatelor monitorizării particulelor și microorganismelor, ar trebui stabilite limite adecvate: nivelul de alarmă și nivelul de acțiune. Procedurile de operare ar trebui să descrie acțiuni corective în cazul în care aceste limite sunt depășite.
V. TEHNOLOGIA IZOLĂRII28. (21) Utilizarea tehnologiei de izolare minimizează intervenția umană în zonele de producție, rezultând un risc semnificativ redus de contaminare microbiană a produselor fabricate aseptic din mediul de producție. Există multe tipuri de izolatori și dispozitive de transfer. Izolatorul și componentele sale trebuie proiectate astfel încât în zona relevantă să fie posibil calitatea cerută aer. Izolatoarele realizate din diferite materiale sunt mai mult sau mai puțin susceptibile la deteriorarea izolației și la depresurizare. Dispozitivele de transfer pot varia de la modele cu uși simple sau duble până la sisteme complet etanșe care includ dispozitive de sterilizare.
29. (22) Transferul de materiale în și din izolator este una dintre cele mai mari surse potențiale de contaminare. De obicei, spațiul din interiorul izolatorului este o zonă limitată pentru operațiuni care prezintă riscuri mari pentru calitatea produsului. În același timp, se presupune că nu poate exista un flux de aer laminar în zona de lucru a tuturor acestor dispozitive.
30. (23) Cerințele privind puritatea aerului din mediul care înconjoară izolatorul depind de proiectarea izolatorului și de scopul acestuia. Puritatea acestui mediu trebuie controlată și trebuie să fie de cel puțin clasa D pentru producția aseptică.
31. (24) Izolatoarele pot fi puse în funcțiune numai după ce a fost efectuată validarea corespunzătoare. Validarea trebuie să ia în considerare toți factorii critici ai tehnologiei izolatorului, în special calitatea aerului din interiorul și din exteriorul izolatorului, procedurile de dezinfectie a izolatorului, procesele de transfer și integritatea izolatorului.
32. (25) Trebuie efectuată o monitorizare continuă, inclusiv testarea frecventă a etanșării izolatorului și a ansamblurilor mănuși-manșon.
VI. TEHNOLOGIA „SUFLARE – UMPLARE – SIGILARE”.33. (26) Dispozitivul suflare-umplere-etanşare este un dispozitiv de construcţie specială, în care într-un complex automat, pe parcursul unui ciclu tehnologic continuu, se formează ambalaje din granule termoplastice, care sunt umplute cu produs şi sigilate. Un dispozitiv de suflare-umplere-etanșare utilizat în procesarea aseptică și având o zonă de clasă A cu flux de aer eficient poate fi instalat cel puțin într-o zonă de clasă C, cu condiția ca îmbrăcămintea utilizată în clasa A și/sau zonele B să fie purtată mediul în stare echipată trebuie să respecte standardele stabilite pentru particule și microorganisme, iar în stare de funcționare - numai pentru microorganisme. Echipamentele cu suflare-umplere-sigilare utilizate la fabricarea produselor sterilizate terminal trebuie instalate cel puțin într-o zonă de Clasa D.
34. (27) Având în vedere caracteristicile acestei tehnologii, este necesar să se acorde o atenție deosebită:
proiectarea și calificarea echipamentelor;
validarea și reproductibilitatea proceselor de curățare în loc și de sterilizare în loc;
Spațiul camerei curate, care este mediul de producție pentru echipamentele adăpostite acolo;
pregătirea operatorilor și îmbrăcămintea;
Activități în zona critică a echipamentului, inclusiv realizarea conexiunilor și asamblarea în condiții aseptice înainte de umplere.
VII. PRODUSE SUPUSE STERILIZĂRII FINALE35. (28) Pregătirea componentelor de ambalare primară și a altor materiale și fabricarea majorității produselor ar trebui să se desfășoare cel puțin într-un mediu de producție din clasa D pentru a se asigura că riscurile de contaminare cu particule și microorganisme sunt suficient de scăzute pentru a sprijini filtrarea și sterilizarea. . Dacă contaminarea microbiană prezintă un risc ridicat sau special pentru produs (în special atunci când produsul este un bun teren propice pentru creșterea microorganismelor sau este precedat de o perioadă lungă de timp pentru sterilizare sau procesul se desfășoară în mare parte în recipiente deschise) , pregătirea trebuie efectuată într-un mediu de clasă C.
36. (29) Umplerea produselor care urmează a fi sterilizate terminal trebuie efectuată într-un mediu de producție de cel puțin clasa C.
37. (30) În cazul în care există un risc crescut de contaminare a produsului din mediul procesului, în special în cazul în care operațiunile de umplere sunt lente sau ambalajele au gura largă sau trebuie să fie menținute deschise mai mult de câteva secunde înainte de sigilare, umplerea ar trebui să se desfășoară într-un mediu de clasă A, cel puțin clasa C. Prepararea și ambalarea unguentelor, cremelor, suspensiilor și emulsiilor înainte de sterilizarea finală trebuie, de regulă, să fie efectuate într-un mediu de producție de clasa C.
VIII. PRODUCȚIE ASEPTICĂ38. (31) Manipularea componentelor ambalajului primar și a altor materiale după curățare trebuie efectuată într-un mediu de lucru de cel puțin Clasa D. Prelucrarea materiilor prime și componentelor sterile, cu excepția cazului în care este prevăzută sterilizare ulterioară sau filtrare sterilizantă, trebuie efectuată. in zona de lucru Clasa A cu mediu de productie Clasa B.
39. (32) Pregătirea soluţiilor care sunt supuse filtrării sterilizatoare în timpul procesului trebuie efectuată într-un mediu de producţie de Clasa C Dacă nu se efectuează filtrarea prin sterilizare, atunci trebuie efectuată pregătirea materialelor şi producerea produselor într-o zonă de lucru de clasă A cu un mediu de producție de clasă B.
40. (33) Prelucrarea și umplerea produselor preparate aseptic trebuie efectuate într-o zonă de lucru de clasa A cu mediu de proces de clasa B.
41. (34) Transferul ambalajelor primare parțial sigilate de produse, cum ar fi produsele liofilizate, înainte de finalizarea procesului de acoperire trebuie efectuat fie într-o zonă de clasă A situată într-un mediu de producție de clasă B, fie în recipiente de transfer sigilate într-un Mediu de producție clasa B.
42. (35) Prepararea și umplerea unguentelor, cremelor, suspensiilor și emulsiilor sterile trebuie efectuate într-o zonă de clasa A situată într-un mediu de fabricație de clasa B dacă produsul se află în recipiente deschise și nu este supus ulterior filtrării sterilizante.
IX. PERSONAL43. (36) În zonele curate este permis doar numărul minim necesar de personal, ceea ce este deosebit de important pentru producția aseptică. Operațiunile de inspecție și control, acolo unde este posibil, trebuie efectuate în afara zonelor curate.
44. (37) Tot personalul (inclusiv personalul de curățenie și întreținere) care lucrează în astfel de zone ar trebui să beneficieze de formare regulată în ceea ce privește producerea adecvată a produselor sterile, inclusiv igiena și microbiologia de bază. Dacă este nevoie ca persoanele neautorizate care nu au urmat o astfel de pregătire (de exemplu, constructorii contractuali sau ajustatorii de echipamente) să se afle într-o cameră curată, atunci aceste persoane trebuie să fie supuse unor instrucțiuni detaliate și să fie strict supravegheate.
45. (38) Intrarea în zonele sterile de producție a personalului care lucrează cu materii prime din țesuturi animale sau cu culturi microbiene care nu sunt utilizate în procesul curent este permisă numai dacă personalul respectă procedurile de intrare stabilite.
46. (39) Este necesar să se respecte cerințele de igienă și curățenie personală. Personalul implicat în producția de medicamente sterile trebuie instruit să raporteze orice circumstanțe care pot determina eliberarea unor cantități sau tipuri inacceptabile de contaminanți; Când apar astfel de circumstanțe, periodic examene medicale angajati. Măsurile care trebuie întreprinse cu privire la personalul care poate fi o sursă de contaminare microbiană ar trebui stabilite de o persoană desemnată cu autoritatea necesară.
47. (40) Este interzisă purtarea ceasurilor de mână, bijuterii sau folosirea produselor cosmetice în zonele curate.
48. (41) Îmbrăcarea și spălarea trebuie efectuate în conformitate cu instrucțiunile aprobate de producător, menite să reducă la minimum riscul de contaminare a îmbrăcămintei din zona curată sau introducerea de contaminanți în îmbrăcămintea din zona curată.
49. (42) Îmbrăcămintea și calitatea acesteia trebuie să corespundă procesului tehnologic și clasei zonei de lucru. Trebuie purtat astfel încât să protejeze produsul de contaminare.
50. (43) Descriere îmbrăcămintea necesară pentru fiecare clasă de curățenie din cameră este dată mai jos:
Clasa D: Părul și barba și mustața (dacă există) trebuie acoperite. Trebuie purtate îmbrăcăminte de protecție obișnuită și încălțăminte adecvată sau huse pentru încălțăminte. Trebuie luate măsuri corespunzătoare pentru a preveni orice contaminare a zonei curate din exterior;
Clasa C: Părul, barba și mustața (dacă există) trebuie acoperite. Trebuie să purtați o salopetă sau un costum-pantaloni care să se potrivească bine la încheieturi și să aibă guler înalt, precum și pantofi sau huse de pantofi adecvate. Nu ar trebui să existe practic fibre sau particule care se desprind de pe îmbrăcăminte și pantofi;
Clasa A/B: Articolele pentru acoperirea capului trebuie să acopere complet părul, barba și mustața (dacă există) și trebuie introduse în gulerul costumului și trebuie purtată o mască de față pentru a preveni răspândirea picăturilor. De asemenea, trebuie purtate mănuși de cauciuc sau plastic sterilizate corespunzător și fără pudră, precum și pantofi sterilizați sau dezinfectați. Marginile inferioare ale picioarelor pantalonilor trebuie să fie înfipte în pantofi, iar mânecile îmbrăcămintei să fie înfipte în mănuși. Îmbrăcămintea de protecție nu ar trebui să elibereze practic fibre sau particule și ar trebui să prindă particulele eliberate din corp.
51. (44) Îmbrăcămintea de stradă este interzisă să fie adusă în vestiarele care duc la zonele de clasă B și C. Fiecare angajat dintr-o zonă de clasă A/B trebuie să aibă îmbrăcăminte de protecție curată, sterilă (sterilizată sau igienizată corespunzător) pentru fiecare lucru. schimbare. Mănușile trebuie dezinfectate în mod regulat în timpul lucrului. Măștile și mănușile trebuie schimbate cel puțin la fiecare schimb.
52. (45) Îmbrăcămintea pentru camera curată ar trebui să fie curățată și tratată astfel încât să nu provoace ulterior contaminare. Aceste operațiuni trebuie efectuate în conformitate cu instrucțiunile aprobate. Pentru a pregăti astfel de haine, este indicat să aveți spălătorii separate. Prelucrarea necorespunzătoare a îmbrăcămintei dăunează fibrelor țesăturii, crescând riscul separării particulelor.
X. LOCURI53. (46) În zonele curate, toate suprafețele expuse trebuie să fie netede, impermeabile și nedeteriorate pentru a minimiza formarea și acumularea de particule sau microorganisme și pentru a permite utilizarea repetată a agenților de curățare și, dacă este necesar, a dezinfectanților.
54. (47) Pentru a reduce acumularea de praf și pentru a facilita curățarea, încăperile ar trebui să fie lipsite de adâncituri care nu pot fi curățate și să aibă cât mai puține margini proeminente, rafturi, dulapuri și echipamente. Ușile trebuie proiectate fără adâncituri inaccesibile pentru curățare; nu este recomandată utilizarea ușilor glisante.
55. (48) Plafoanele suspendate trebuie sigilate pentru a preveni intrarea contaminanților din spațiul de deasupra lor.
56. (49) Instalarea conductelor, conductelor de aer și a altor echipamente trebuie efectuată în așa fel încât să nu existe adâncituri sau deschideri neînchise și să nu existe suprafețe care să nu fie accesibile pentru curățare.
57. (50) Chiuvetele și scurgerile sunt interzise în zonele de clasă A și B utilizate pentru prelucrare aseptică. În alte zone, este necesar să se asigure o întrerupere a jetului între echipamente și conducta de canalizare(pâlnie). Canalele de scurgere de podea din camerele curate din clasa inferioară trebuie să fie prevăzute cu sifoane sau sifone pentru a preveni refluxul.
58. (51) Vestiarele ar trebui să fie proiectate ca sase de aer și ar trebui utilizate pentru a asigura separarea fizică diferite etape schimbarea îmbrăcămintei și astfel se reduce la minimum contaminarea îmbrăcămintei de protecție cu microorganisme și particule. Ele trebuie să curgă eficient cu aer filtrat. Zona înainte de părăsirea încăperii (incintei) pentru schimbarea hainelor, atunci când este echipată, trebuie să aibă aceeași clasă de curățenie ca și zona către care duce. In unele cazuri, este indicat sa ai incaperi separate (localuri) pentru schimbarea hainelor pentru intrarea si iesirea din zonele curate. Ca regulă generală, instalațiile pentru spălarea mâinilor ar trebui să fie amplasate numai la începutul vestiarelor.
59. (52) Ambele uși de blocare nu pot fi deschise în același timp. Un sistem de închidere sau un sistem de avertizare vizuală și/sau sonoră trebuie să fie funcțional pentru a preveni deschiderea mai multor uși în același timp.
60. (53) Alimentarea cu aer filtrat trebuie să mențină o diferență de presiune pozitivă față de zonele de proces de clasa inferioară în toate condițiile de funcționare, iar fluxul de aer trebuie să fie eficient în jurul zonei. Camerele adiacente cu diferite clase de curățenie ar trebui să aibă o diferență de presiune de 10 - 15 Pa (valoare standard). O atenție deosebită trebuie acordată protecției zonei cu cel mai mare risc pentru calitatea produsului, adică mediului de producție la care sunt expuse direct produsul sau componentele curățate în contact cu produsul. Sunt permise variații în ceea ce privește alimentarea cu aer și diferențele de presiune care pot fi necesare din cauza prezenței anumitor materiale, în special viruși sau materiale bacteriene sau preparate ale acestora patogeni, foarte toxici, radioactivi sau vii. Unele operațiuni pot necesita decontaminarea spațiilor și echipamentelor și tratarea aerului îndepărtat din zona curată.
61. (54) Este necesar să se confirme că direcția fluxului de aer nu prezintă un risc de contaminare a produsului, inclusiv să se asigure că zona care prezintă cele mai mari riscuri pentru calitatea produsului nu este transportată cu fluxul de aer. de particulele emise de personalul de service, operaţiunea sau echipamentul în curs de executare.
62. (55) În caz de defecțiune a sistemului de ventilație, trebuie prevăzut un sistem de avertizare de urgență. Dacă diferența de presiune între două încăperi este critică, trebuie instalați senzori de presiune diferențială între ele. Valorile căderii de presiune ar trebui înregistrate în mod regulat sau documentate în alt mod.
XI. ECHIPAMENTE63. (56) O bandă transportoare nu trebuie să fie permisă să treacă printr-un compartiment despărțitor care separă o zonă de clasă A sau B de o zonă de producție cu puritate inferioară a aerului decât dacă banda în sine este supusă sterilizării continue (de exemplu, într-un tunel de sterilizare).
64. (57) Se recomandă ca echipamentele, armăturile (conexiunile) și zonele de service să fie proiectate și instalate astfel încât lucrările la echipament, întreținerea și reparațiile acestuia să poată fi efectuate în afara zonei curate. Dacă este necesară sterilizarea, aceasta trebuie efectuată după ce echipamentul a fost asamblat cât mai complet posibil.
65. (58) În cazul în care întreținerea echipamentului s-a efectuat într-o zonă curată și au fost încălcate standardele de curățenie și/sau asepsie cerute în timpul acestei lucrări, atunci zona trebuie curățată, dezinfectată și/sau sterilizată (oricum este cazul) . ) până la reluarea procesului.
66. (59) Stațiile de tratare a apei și sistemele de distribuție ar trebui proiectate, construite și exploatate pentru a asigura o alimentare fiabilă cu apă de o calitate adecvată. Ele nu pot fi operate peste capacitatea lor proiectată. Apa pentru preparate injectabile trebuie produsă, depozitată și distribuită astfel încât să se prevină dezvoltarea microorganismelor, de exemplu prin circulația constantă a acesteia la temperaturi peste 70 °C.
67. (60) Toate echipamentele precum sterilizatoare, sisteme de tratare a aerului și filtrare, aer și filtre de gaz, sistemele de tratare a apei, recepție, stocare și distribuție trebuie să fie supuse validării și întreținerii de rutină, iar repunerea lor în funcțiune trebuie să fie autorizată de o persoană cu autoritate corespunzătoare.
XII. TRATAMENT SANITAR68. (61) Igienizarea zonelor curate este în special important. Zonele trebuie curățate temeinic în conformitate cu instrucțiunile aprobate de producător. Când se efectuează dezinfecția, trebuie utilizate mai multe tipuri de dezinfectanți. Pentru a detecta dezvoltarea tulpinilor rezistente de microorganisme, este necesară monitorizarea regulată.
69. (62) Detergenții și dezinfectanții trebuie controlați pentru puritatea microbiologică. Soluțiile lor trebuie păstrate în recipiente (recipiente) precurățate și depozitate numai pentru termenele stabilite, cu excepția acelor soluții care sunt sterilizate. Agenții de curățare și dezinfectanți utilizați în zonele de clasă A și B trebuie să fie sterili înainte de utilizare.
70. (63) Fumigarea zonelor curate poate fi utilă pentru a reduce contaminarea microbiană în zonele inaccesibile.
XIII. PROCES71. (64) În toate etapele producției, inclusiv cele înainte de sterilizare, ar trebui luate măsuri pentru a minimiza contaminarea.
72. (65) Nu este permisă producerea de medicamente de origine microbiologică sau completarea acestora în zonele utilizate pentru producerea altor medicamente. Vaccinurile care conțin microorganisme ucise sau extracte bacteriene, după inactivare, pot fi ambalate în aceleași unități ca și alte medicamente sterile.
73. (66) Validarea proceselor efectuate în condiții aseptice ar trebui să includă simularea procesului folosind medii de cultură (încărcarea mediului). Mediul de cultură trebuie selectat ținând cont de forma de dozare a medicamentului, precum și de selectivitatea, transparența, concentrația și adecvarea mediului de cultură pentru sterilizare.
74. (67) Modelarea procesului ar trebui să simuleze îndeaproape procesul de fabricație aseptică în serie și să includă etapele sale critice secvențiale. De asemenea, este necesar să se ia în considerare diversele intervenții care pot apărea în timpul procesului normal de producție, precum și situațiile „cel mai rău caz”.
75. (68) Simularea procesului pentru validarea inițială ar trebui să includă trei teste consecutive satisfăcătoare pentru fiecare schimb de operator. Acestea trebuie apoi repetate la intervale specificate și după orice modificare semnificativă a sistemului HVAC, echipamentului, procesului sau numărului de schimburi. Testele de simulare a procesului trebuie repetate de două ori pe an pentru fiecare schimb de operator și pentru fiecare proces.
76. (69) Numărul de recipiente (ambalaje primare) destinate ambalării mediilor de cultură ar trebui să fie suficient pentru a asigura o evaluare fiabilă. În cazul loturilor mici, numărul de recipiente pentru ambalarea mediilor de cultură trebuie să corespundă, cel puțin, cu dimensiunea lotului de produs. Este necesar să se depună eforturi pentru absența creșterii microbiene și se aplică următoarele standarde:
A) dacă au fost umplute mai puțin de 5.000 de unități de produs, nu ar trebui să existe o singură unitate contaminată;
B) dacă ați completat de la 5.000 la 10.000 de unități de produs, atunci:
o (1) unitate contaminată justifică investigarea și reambalarea mediilor de cultură;
două (2) unități contaminate - investigarea cauzei și revalidarea în curs;
c) dacă au fost umplute mai mult de 10.000 de unități, atunci:
un (1) articol contaminat justifică o investigare a cauzei;
două (2) unități contaminate - investigarea cauzei și revalidarea în curs.
77. (70) Pentru orice număr de recipiente de mediu de cultură primar, cazurile ocazionale de contaminare microbiană pot indica prezența unor niveluri scăzute de contaminanți și ar trebui investigate. Dacă este detectată o contaminare microbiană semnificativă, ar trebui luat în considerare posibilul impact asupra sterilității loturilor eliberate de la ultimul test de umplere cu mediu reușit.
78. (71) Este necesar să se asigure că orice validare nu prezintă un risc pentru procese.
79. (72) Aprovizionarea cu apă, echipamentele de tratare a apei și apa preparată sunt supuse monitorizării regulate pentru prezența contaminanților chimici și biologici și cazurile necesare pentru endotoxine. Rezultatele monitorizării și orice acțiuni întreprinse trebuie să fie documentate.
80. (73) În zonele curate, în special în timpul proceselor de fabricație aseptică, activitatea personalului ar trebui să fie redusă la minimum, iar mișcarea ar trebui să fie măsurată și controlată pentru a evita eliberarea excesivă de particule și microorganisme din cauza activității fizice crescute. Temperatura si umiditatea mediu nu trebuie sa fie foarte mare pentru a nu crea disconfort, tinand cont de proprietatile hainelor folosite.
81. (74) Contaminarea microbiană a materiilor prime și a materialelor ar trebui să fie minimă. Specificațiile pentru acestea trebuie să includă cerințe privind puritatea microbiologică.
82. (75) În zonele curate, prezența recipientelor și a materialelor din care fibrele pot fi separate ar trebui redusă la minimum.
83. (76) Trebuie luate măsuri pentru a preveni contaminarea cu particule a produselor finite.
84. (77) După finalizarea procesului de curățare, componentele, recipientele și echipamentele trebuie manipulate astfel încât să nu fie recontaminate.
85. (78) Intervalele de timp dintre spălarea, uscarea și sterilizarea componentelor, recipientelor și echipamentelor, precum și între sterilizarea acestora și utilizarea ulterioară, trebuie să fie reduse la minimum și limitate în timp în funcție de condițiile de depozitare.
86. (79) Timpul dintre începutul preparării soluției și sterilizarea sau filtrarea sterilizantă a acesteia trebuie să fie minim. Pentru fiecare tip de produs este necesar să se stabilească un timp maxim admisibil, ținând cont de compoziția acestuia și ordinea stabilită depozitare
87. (80) Nivelurile de contaminare microbiană trebuie monitorizate înainte de sterilizare. Trebuie stabilite limite de operare pentru contaminare imediat înainte de sterilizare, care sunt legate de eficacitatea metodei utilizate. Nivelul de contaminare microbiană trebuie cuantificat pentru fiecare lot de produse umplute aseptic și sterilizate terminal. Dacă se stabilesc parametri de sterilizare mai stringenți pentru medicamentele sterilizate în stadiu terminal, nivelul de contaminare microbiană poate fi monitorizat doar la intervale programate adecvate. Atunci când se utilizează sisteme de eliberare parametrizată, determinarea contaminării microbiene trebuie efectuată lot cu lot și considerată ca un test în proces. Dacă este necesar, nivelurile de endotoxine trebuie monitorizate. Toate soluțiile, în special fluidele de perfuzie cu volum mare, trebuie supuse unei filtrări de sterilizare, dacă este posibil, imediat înainte de umplere.
88. (81) Componentele, containerele, echipamentele și orice alte articole necesare într-o zonă curată, în special atunci când se lucrează în condiții aseptice, ar trebui să fie sterilizate și transferate acolo printr-un sterilizator de trecere montat pe perete, cu acces în două sensuri sau alte mijloace. care previn contaminarea. Gazele neinflamabile trebuie să treacă prin filtre care rețin microorganisme.
89. (82) Eficacitatea oricărui proces nou ar trebui să fie demonstrată prin validare, care ar trebui repetată în mod regulat, în conformitate cu un plan bazat pe calendar, și prin orice modificare semnificativă a procesului sau a echipamentului.
XIV. STERILIZARE90. (83) Toate procesele de sterilizare ar trebui validate. O atenție deosebită este necesară dacă metoda de sterilizare utilizată nu este descrisă în Farmacopeea de stat a Federației Ruse sau este utilizată pentru un produs care nu este o simplă soluție apoasă sau uleioasă. Metoda preferată este sterilizarea termică. În orice caz, metoda de sterilizare trebuie să respecte licența de producție și dosarul de înregistrare.
91. (84) Înainte de a selecta orice proces de sterilizare, acesta trebuie demonstrat prin măsurători fiziceși, dacă este posibil, indicatori biologici că este potrivit pentru produs și este eficient în realizarea condițiilor de sterilizare necesare în toate părțile fiecărui tip de încărcătură. Validarea procesului trebuie repetată la intervale programate, dar cel puțin o dată pe an și întotdeauna în cazul introducerii schimbări semnificativeîn echipament. Înregistrările rezultatelor trebuie păstrate.
92. (85) Pentru o sterilizare eficientă, întregul material trebuie supus tratamentului necesar, iar procesul trebuie organizat astfel încât să se asigure că este atinsă eficacitatea dorită.
93. (86) Metodele de încărcare ar trebui dezvoltate și validate pentru toate procesele de sterilizare.
94. (87) Utilizarea indicatorilor biologici ar trebui considerată doar ca o metodă suplimentară de monitorizare a sterilizării. Indicatorii biologici trebuie păstrați și utilizați în conformitate cu instrucțiunile producătorului, iar calitatea acestora trebuie monitorizată prin metode de control pozitiv. Când se folosesc indicatori biologici, trebuie luate măsuri stricte pentru a preveni contaminarea microbiană de la indicatorii înșiși.
95. (88) Măsurile ar trebui definite clar pentru a asigura separarea produselor sterilizate și nesterilizate. Fiecare coș, tavă sau alt recipient pentru produs sau componente trebuie să fie clar etichetat cu numele materialului, numărul lotului și dacă a fost sau nu sterilizat. Dacă este necesar, indicatori precum banda de autoclavă pot fi utilizați pentru a indica dacă un lot (sau o parte a unui lot) a fost supus procesului de sterilizare, dar nu oferă dovezi sigure că lotul este cu adevărat steril.
96. (89) Înregistrările trebuie compilate pentru fiecare ciclu de sterilizare și trebuie aprobate ca parte a procesului de eliberare a lotului.
XV. STERILIZARE TERMICĂ97. (90) Fiecare ciclu de sterilizare termică ar trebui înregistrat ca o diagramă timp-temperatură la o scară suficient de mare sau să fie înregistrat utilizând alt echipament adecvat, cu acuratețea și precizia necesare. Locația senzorilor de temperatură utilizați pentru monitorizare și/sau înregistrare trebuie determinată în timpul validării și, dacă este necesar, verificată și cu un alt senzor de temperatură independent situat în aceeași locație.
98. (91) Pot fi utilizați indicatori chimici și biologici, dar nu ar trebui să înlocuiască măsurătorile fizice.
99. (92) Trebuie acordat timp suficient pentru ca întreaga încărcătură să atingă temperatura necesară înainte de începerea timpului de sterilizare. Această perioadă trebuie determinată pentru fiecare tip de încărcătură care se sterilizează.
100. (93) După finalizarea fazei de temperatură ridicată a unui ciclu de sterilizare termică, trebuie luate măsuri de precauție pentru a preveni contaminarea încărcăturii sterilizate în timpul răcirii. Orice lichid de răcire sau gaz care intră în contact cu produsul trebuie să fie sterilizat, cu excepția cazului în care se exclude posibilitatea utilizării ambalajelor cu scurgeri și se furnizează dovezi adecvate.
XVI. STERILIZARE101. (94) La sterilizarea cu abur, temperatura și presiunea trebuie controlate. Se recomandă ca controalele să fie independente de dispozitivele de monitorizare și înregistrare. Dacă în acest scop sunt utilizate sisteme automate de control și monitorizare, acestea trebuie validate pentru a se asigura că îndeplinesc cerințele critice ale procesului. Încălcările în timpul procesului trebuie înregistrate de sistem și sub supravegherea operatorului. În timpul procesului de sterilizare, citirile independente ale senzorului de temperatură trebuie verificate constant în raport cu datele din diagrama dispozitivului de înregistrare. Pentru sterilizatoarele care au o scurgere în partea inferioară a camerei, poate fi necesar să se înregistreze temperatura în acest punct pe tot parcursul ciclului de sterilizare. Dacă ciclul de sterilizare include o etapă de vid, atunci este necesar să verificați în mod regulat camera pentru scurgeri.
102. (95) Articolele de sterilizat care nu se află în recipiente sigilate trebuie să fie învelite într-un material care să permită trecerea aerului și aburului, dar să împiedice recontaminarea articolelor după sterilizare. Este necesar să se asigure contactul tuturor părților încărcăturii cu agentul de sterilizare la temperatura și timpul specificat.
103. (96) Este necesar să se asigure că aburul utilizat pentru sterilizare este de calitate adecvată și nu conține atât de multe impurități încât ar putea provoca contaminarea produsului sau a echipamentului.
XVII. STERILIZARE LA CĂLDURĂ USCĂ104. (97) În timpul sterilizării la căldură uscată, trebuie asigurată circulația aerului în interiorul camerei și întreținerea. suprapresiune pentru a preveni intrarea aerului steril în el. Orice aer care intră trebuie să treacă prin filtre de înaltă eficiență (filtru HEPA). Dacă sterilizarea implică eliminarea pirogenilor, atunci testarea specifică endotoxinei trebuie efectuată ca parte a validării.
XVIII. STERILIZARE POR RADIAȚII105. (98) Sterilizarea prin radiații este utilizată în primul rând pentru sterilizarea materialelor și produselor termosensibile. Multe medicamente și unele materiale de ambalare sunt sensibile la radiațiile ionizante, prin urmare, această metodă este acceptabilă numai atunci când absența influență nocivă pentru produse. În general, iradierea cu ultraviolete nu este o metodă de sterilizare acceptabilă.
106. (99) În timpul procesului de sterilizare, trebuie efectuată măsurarea dozei absorbite radiatii ionizante. Pentru a face acest lucru, trebuie utilizate dozimetre, ale căror citiri nu depind de rata dozei de radiație utilizată, dar care oferă o înregistrare cantitativă a dozei de radiații absorbite de produsul însuși. Dozimetrele trebuie plasate printre încărcături în număr suficient și la distanțe suficient de apropiate unul de celălalt pentru a se asigura că dozimetrele sunt prezente în toate zonele expuse la radiații. Dozimetrele din plastic trebuie utilizate numai în perioada de valabilitate a calibrării lor. Citirile dozimetrului trebuie luate într-o perioadă scurtă de timp după expunere.
107. (100) Indicatorii biologici pot fi utilizați ca mijloc de control suplimentar.
108. (101) Procedurile de validare ar trebui să asigure luarea în considerare a efectelor diferitelor densități de ambalare ale produselor sterilizate.
109. (102) Procedurile de manipulare a materialelor ar trebui să prevină confuzia între materialele iradiate și cele neiradiate. Pe fiecare pachet trebuie aplicați indicatori de culoare sensibili la radiații pentru a face distincția între ambalajele iradiate și cele neiradiate.
110. (103) Doza totală absorbită de radiații trebuie să fie acumulată în timpul alocat procesului de sterilizare.
XIX. STERILIZARE OXID DE ETILEN111. (104) Această metodă poate fi utilizată numai atunci când este imposibil să se utilizeze o altă metodă. În timpul validării procesului, trebuie dovedit că nu există niciun efect dăunător asupra produsului și că condițiile și timpul prevăzut pentru degazare sunt astfel încât cantitatea de gaz rezidual și de produse de reacție să se încadreze în limitele acceptabile stabilite pentru acest tip de produs. sau material.
112. (105) Contactul direct între gaz și microorganisme este esențial. Trebuie luate măsuri de precauție împotriva includerii de microorganisme în material (de exemplu, cristale sau proteine uscate). Tipul și cantitatea materialelor de ambalare pot afecta în mod semnificativ procesul.
113. (106) Înainte de tratarea gazelor, trebuie să se asigure că umiditatea și temperatura materialelor corespund cerințelor procesului. Timpul necesar pentru aceasta ar trebui să fie cât mai minim posibil.
114. (107) Fiecare ciclu de sterilizare ar trebui monitorizat folosind indicatori biologici adecvați, a căror cantitate necesară trebuie distribuită uniform în întreaga încărcătură. Informațiile obținute în acest caz ar trebui să facă parte din dosarul pentru lotul de produse finite.
115. (108) Trebuie ținute înregistrări pentru fiecare ciclu de sterilizare care să indice momentul la care a fost finalizat ciclul, presiunea, temperatura și umiditatea din cameră în timpul procesului, precum și concentrația și cantitatea totală de gaz utilizată. Presiunea și temperatura trebuie înregistrate pe o diagramă pe tot parcursul ciclului. Aceste înregistrări ar trebui să facă parte din dosarul lotului de produs finit.
116. (109) Încărcătura după sterilizare trebuie depozitată în condiții controlate și ventilate pentru a se asigura că gazele reziduale și produșii de reacție sunt reduse la limita specificată. Acest proces trebuie validat.
XX. FILTRAREA MEDICAMENTELOR CARE NU POT FI STERILIZATE ÎN AMBALAJUL FINAL117. (110) Efectuarea filtrării sterilizante nu este condiție suficientă sterilizare, dacă este posibilă sterilizarea produselor în ambalajul final. Metoda preferată este sterilizarea cu abur. Dacă produsele nu pot fi sterilizate în ambalajul final, soluțiile sau lichidele pot fi filtrate printr-un filtru steril cu o dimensiune nominală a porilor de 0,22 µm (sau mai puțin) sau un filtru cu capacitate similară de reținere microbiană în recipiente presterilizate. Aceste filtre pot elimina majoritatea bacteriilor și mucegaiurilor, dar nu toți virușii sau micoplasmele. Prin urmare, trebuie luată în considerare posibilitatea suplimentării procesului de filtrare cu un anumit grad de tratament termic.
118. (111) Datorită riscului suplimentar potențial asociat cu filtrarea prin sterilizare în comparație cu alte procese de sterilizare, se recomandă filtrarea repetată printr-un filtru suplimentar de sterilizare pentru a reține microorganismele imediat înainte de ambalare. Filtrarea finală de sterilizare trebuie efectuată cât mai aproape de locul de umplere.
119. (112) Trebuie utilizate filtre cu o separare minimă a fibrelor.
120. (113) Înainte de utilizare și imediat după utilizare, integritatea filtrului de sterilizare trebuie verificată printr-o metodă cum ar fi punctul de bule, fluxul de difuzie sau testarea presiunii. Validarea ar trebui să determine timpul necesar pentru filtrarea unui anumit volum de soluție și căderea de presiune pe filtru. Orice abateri semnificative de la parametrii specificați în timpul producției în curs trebuie înregistrate și investigate. Rezultatele acestor controale trebuie incluse în dosarul lotului de produse. Imediat după utilizare, integritatea gazului critic și filtre de aer. Integritatea altor filtre trebuie confirmată la intervale adecvate.
121. (114) Nu este permisă folosirea aceluiași filtru mai mult de o zi lucrătoare, cu excepția cazului în care a fost validată posibilitatea unei utilizări mai îndelungate.
122. (115) Filtrul nu trebuie să afecteze produsul prin reținerea ingredientelor acestuia sau prin eliberarea oricăror substanțe în el.
XXI. FINALIZAREA PROCESULUI DE PRODUCERE A PRODUSELOR STERILE123. (116) Flacoanele parțial sigilate, după terminarea liofilizării, trebuie păstrate într-o zonă de clasă A până când sunt în final acoperite.
124. (117) Containerele (pachetele primare) trebuie sigilate folosind metode adecvate care au fost validate. Atunci când se utilizează o metodă de etanșare, de exemplu, fiole de sticlă sau plastic, toate produsele sunt supuse unui control de integritate 100%. În alte cazuri, controlul integrității produsului trebuie efectuat folosind metode stabilite.
125. (118) Sistemul de închidere pentru flacoanele umplute în condiții aseptice nu este complet intact până când capacul (capacul) de aluminiu este sertizat (rulat) pe flaconul cu dop. În acest sens, sertizarea capacului după acoperire cu un dop trebuie efectuată cât mai curând posibil.
126. (119) Deoarece cantități mari de particule mecanice pot fi eliberate la sertizarea capacelor, echipamentul de sertizare trebuie să fie amplasat separat și echipat cu un sistem de evacuare a aerului.
127. (120) Sertizarea flacoanelor poate fi efectuată ca parte a procesului aseptic folosind capace sterilizate sau într-un mediu de cameră curată în afara zonei aseptice. În acest din urmă caz, flacoanele trebuie să fie protejate de o zonă de clasă A până când părăsesc zona aseptică, iar ulterior flacoanele închise cu dop trebuie protejate de o sursă de aer curat de clasă A până când capacele sunt sertizate pe ele.
128. (121) Flacoanele fără dop sau cu dop deplasat trebuie îndepărtate înainte de sertizarea capacului. Dacă este necesară intervenția umană la sertizarea capacelor, trebuie utilizată o tehnologie adecvată pentru a evita contactul direct cu flacoanele și pentru a minimiza contaminarea microbiană.
129. (122) Bariere sau izolatoare care restricționează accesul la zona de lucru, oferind condițiile necesare și minimizând accesul direct al omului la operația de sertizare.
130. (123) Ambalajele primare sigilate sub vid (ambalaje în vid) trebuie testate pentru reținerea în vid după o perioadă de timp prestabilită.
131. (124) Ambalajul primar al produselor pentru administrare parenterală trebuie verificat individual (buc cu bucată) pentru prezența incluziunilor străine sau a altor neconcordanțe de calitate. Inspecția vizuală trebuie efectuată la nivelurile de iluminare stabilite și pe fundalul câmpului de lucru. Este necesar să se verifice în mod regulat vederea operatorilor care efectuează inspecția vizuală (dacă operatorii folosesc ochelari, atunci testul vederii se efectuează cu ochelari). În timpul inspecției vizuale a produselor, se recomandă organizarea de pauze frecvente în munca operatorilor. La utilizarea altor metode de control, procesul de control trebuie validat, iar starea echipamentului trebuie verificată periodic. Rezultatele inspecției vizuale trebuie să fie documentate.
XXII. CONTROLUL CALITATII132. (125) Testarea sterilității produselor finite ar trebui să fie considerată doar pasul final al seriei. activitati de control garantând sterilitatea. Procedura de testare a sterilității trebuie validată pentru fiecare produs.
133. (126) În cazurile în care s-a obţinut permisiunea pentru producerea de produse sterile conform parametrilor (Anexa nr. 17 la prezentele Norme), o atenţie deosebită trebuie acordată validării şi controlului întregului proces tehnologic.
134. (127) Eșantionul de probe de produs prelevat pentru testarea sterilității trebuie să fie reprezentativ pentru întregul lot și trebuie să includă probe prelevate din acele părți ale lotului care se preconizează că vor prezenta cel mai mare risc de contaminare, în special:
A) (a) pentru produsele umplute în condiții aseptice, eșantioanele trebuie să includă recipientele (pachetele primare) umplute la începutul și sfârșitul producției lotului și după orice intervenție semnificativă;
b) (b) Pentru produsele care au fost sterilizate la căldură în ambalajul final, ar trebui să se ia în considerare prelevarea de probe din părțile potențial cele mai reci ale încărcăturii.
Anexa nr. 2
la Regulamentul organizaţiei
producție și control al calității
medicamente
PRIVIND APROBAREA REGULUI DE BUNE PRACTICI DE FABRICAȚIE(Înregistrat la Ministerul Justiției al Rusiei la 10 septembrie 2013 nr. 29938)
Notă de la administrația site-ului: textul integral Nu am plasat comanda daca se doreste, poate fi gasita cu usurinta pe site-ul ConsultantPlus. Medicamentele pentru studiile clinice sunt discutate numai în Anexa 13.
Anexa nr. 13
la Regulile propriu-zise
practica industriala
MEDICAMENTE PENTRU STUDII CLINICE
I. PRINCIPIUL
1. Medicamentele pentru studii clinice trebuie să fie fabricate în conformitate cu acestea Reguli și luând în considerare prevederile actelor juridice de reglementare relevante ale Federației Ruse, în funcție de stadiul de dezvoltare a medicamentului. Metodele de lucru trebuie să fie flexibile pentru a se adapta schimbărilor pe măsură ce cunoașterea procesului crește și trebuie să fie adecvate stadiului de dezvoltare a medicamentului.
2. Studiile clinice pot prezenta riscuri suplimentare pentru pacienții care participă la acestea în comparație cu riscurile pentru acei pacienți care iau medicamente înregistrate.
3. Aplicarea acestora Reguli producția de medicamente experimentale are ca scop eliminarea riscurilor pentru pacienți și, de asemenea, asigurarea faptului că rezultatele studiilor clinice nu sunt afectate de siguranța, calitatea sau eficacitatea insuficientă a medicamentului care rezultă din producerea sa necorespunzătoare.
4. Aceste cerințe sunt destinate în mod egal să asigure consistența de la un lot la altul a aceluiași medicament experimental utilizat în același sau în studii clinice diferite și să documentareși justificarea modificărilor în procesul de dezvoltare a unui astfel de medicament.
5. Producția de medicamente pentru investigație este asociată cu o complexitate suplimentară față de producția de medicamente înregistrate din cauza lipsei de proceduri stabilite, a diferențelor existente în designul studiilor clinice și, ca urmare, a cerințelor diferite pentru ambalare, a necesității de randomizare. și codare (mascare, folosirea „metodei”) și, de asemenea, din cauza riscului ridicat de contaminare încrucișată și amestecare a medicamentelor. În plus, datele privind eficacitatea și toxicitatea produselor medicamentoase pot fi incomplete, validarea procesului poate fi incompletă sau pot fi utilizate produse medicamentoase înregistrate care au fost reambalate sau modificate într-un fel. Personalul producătorului trebuie să fie instruit în utilizarea acestora Reguli pentru medicamentele experimentale. Ar trebui stabilită o colaborare cu sponsorii studiilor clinice care sunt responsabili de organizarea studiilor clinice, inclusiv de calitatea medicamentelor studiate. Complexitatea crescută a proceselor tehnologice necesită utilizarea unui sistem de calitate farmaceutic extrem de eficient.
6. Prezentul apendice stabilește, de asemenea, cerințe pentru comandarea, expedierea, transportul și returnarea medicamentelor destinate studiilor clinice.
Medicamente neinvestigative
7. Pacienților li se pot furniza medicamente care nu sunt medicamente experimentale, placebo sau comparatori. Astfel de medicamente pot fi utilizate ca terapie concomitentă sau pentru a furniza îngrijire medicalăîn scopul prevenirii, diagnosticării sau tratamentului și (sau) din cauza necesității de a furniza pacienți îngrijire medicală. Astfel de medicamente pot fi, de asemenea, utilizate în conformitate cu un protocol de studiu clinic pentru a stimula un răspuns fiziologic. Aceste medicamente nu sunt medicamente experimentale și pot fi furnizate de către sponsor sau investigator. Sponsorul trebuie să se asigure că medicamentele sunt în concordanță cu cererea de autorizare a studiului clinic și sunt de calitatea necesară în scopul studiului. În acest sens, el trebuie să ia în considerare sursa medicamentelor, dacă aceste medicamente sunt înregistrate și dacă au fost reambalate. Se recomandă implicarea unei persoane autorizate în această lucrare și luarea în considerare a părerii acestuia.
Licențierea producției și pregătirea pentru utilizare
8. Atât producția completă, cât și etapele individuale de producție a medicamentelor pentru investigație, precum și diferitele procese de separare, ambalare sau transfer ale acestora sunt supuse licenței. Nu este necesară o licență pentru producția de medicamente pentru a se pregăti pentru utilizarea medicamentelor experimentale în organizațiile medicale.
9. În cadrul acestor prevederi, pregătirea pentru utilizare se înțelege ca fiind un proces simplu, cum ar fi:
dizolvarea sau dispersarea medicamentului experimental pentru administrare la un pacient sau
diluarea sau amestecarea medicamentului(lor) investigat(e) cu o altă substanță(e) utilizată(e) ca purtător în scopul administrării medicamentului.
10. Amestecarea mai multor ingrediente împreună, inclusiv substanța activă, pentru a obține un medicament experimental nu constituie un preparat pentru utilizare.
11. Medicamentul experimental trebuie să fie disponibil înainte de a fi pregătit pentru utilizare.
12. Procesul de pregătire pentru utilizare se recomandă a fi efectuat imediat înainte de administrare.
13. Un astfel de proces ar trebui să fie stabilit în cererea de autorizare pentru efectuarea unui studiu clinic și/sau în dosarul medicamentului investigat și în protocolul studiului clinic sau în instrucțiunile corespunzătoare disponibile în organizatie medicala.
II. TERMENI ȘI DEFINIȚII
14. În sensul prezentului apendice, se utilizează următoarele concepte de bază:
dosar pentru un medicament - un set de documente care conțin toate informațiile (sau link-uri către documente relevante) necesare pentru compilare instrucțiuni detaliate pentru producție, ambalare, controlul calității, eliberarea aprobării de eliberare a lotului și expedierea medicamentului experimental;
comandă - o sarcină pentru producerea, ambalarea și (sau) livrarea unui anumit număr de unități ale medicamentului (medicamentelor) investigat(e);
importator al unui medicament pentru investigație - o persoană care are dreptul de a importa un medicament pentru investigație, emis în conformitate cu actele juridice de reglementare ale Federației Ruse;
cercetator - individual, responsabil pentru efectuarea unui studiu clinic într-o organizație medicală. În cazul unui studiu efectuat într-o organizație medicală de către un grup de persoane, cercetătorul (numit și investigatorul principal) este șeful grupului;
produs medicinal experimental - un medicament sau placebo care este investigat sau utilizat ca comparator într-un studiu clinic. Medicamentele de investigație includ și medicamentele deja înregistrate, dacă modalitatea de utilizare sau producere a acestora (forma de dozare sau ambalaj) diferă de cea înregistrată, precum și în cazul utilizării lor pentru indicații care nu au fost încă aprobate sau pentru a obține informații suplimentare despre o formă de dozare deja înregistrată;
studiu clinic - orice studiu efectuat cu participarea unui subiect uman pentru a identifica sau confirma efectele clinice, farmacologice și (sau) alte efecte farmacodinamice ale medicamentului (medicamentelor) experimentale și (sau) pentru a identifica reacțiile adverse la acesta (le) și (sau) să studieze absorbția, distribuția, metabolismul și excreția acestuia (lor) pentru a evalua siguranța și (sau) eficacitatea acesteia;
expediere - operațiuni de ambalare pentru expedierea și transportul medicamentelor de investigație comandate;
medicament comparator - un medicament experimental sau un medicament înregistrat (pentru control activ) sau placebo utilizat pentru comparație în timpul studiilor clinice;
cod de randomizare - o listă care vă permite să determinați ce terapie, ținând cont de randomizare, primește fiecare pacient;
randomizare - procesul de repartizare aleatorie a pacienților în grupuri de tratament sau de control pentru a minimiza subiectivitatea;
Metoda „oarbă” („mascare”) - o metodă în care una sau mai multe părți care participă la studiu nu sunt informate cu privire la scopul (scopurile) terapeutice care sunt îndeplinite. Single-orb înseamnă neconștientizarea pacientului(i), iar dublu-orb înseamnă neconștientizarea tratamentului(lor) administrat(i) pacientului(ilor), investigatorului(i), observatorilor și, în unele cazuri, persoanelor care analizează date. Pentru un medicament experimental, orbirea înseamnă mascarea deliberată a identității medicamentului respectiv în conformitate cu instrucțiunile sponsorului. Demascarea (demascarea) înseamnă dezvăluirea de informații care permit identificarea unui medicament mascat anterior;
sponsor - persoană juridică realizarea organizării unui studiu clinic al unui medicament de uz medical.
III. MANAGEMENTUL CALITĂȚII
15. (1) Sistemul de calitate farmaceutic dezvoltat și testat de producător trebuie să respecte cerințele prezentelor Reguli legate de medicamentele experimentale trebuie să fie documentate și disponibile sponsorului.
16. (2) Specificațiile și instrucțiunile tehnologice pentru medicamentele experimentale se pot modifica în timpul dezvoltării acestora, dar este necesar să se asigure controlul deplin și trasabilitatea tuturor modificărilor.
IV. PERSONAL
17. (3) Tot personalul ale carui activitati sunt legate de medicamentele de cercetare trebuie sa urmeze o pregatire corespunzatoare legata de specificul acestui tip de produs.
18. Chiar și în cazurile în care personalul este mic, ar trebui identificat personal separat responsabil cu producția și controlul calității pentru producția fiecărui lot de medicamente experimentale.
19. (4) Persoana autorizată trebuie să se asigure că există sisteme adecvate care îndeplinesc cerințele prezentului anex. Pentru a face acest lucru, persoana autorizată trebuie să aibă o pregătire adecvată în dezvoltarea de medicamente și studiile clinice. Ghid pentru persoana autorizata conform evaluării medicamentelor studiate se dă în paragrafele 61 - 65 din prezentul apendice.
V. SPECIALE ŞI ECHIPAMENTE
20. (5) Pentru medicamentele experimentale, informațiile privind toxicitatea, potența și proprietățile de sensibilizare pot fi incomplete, iar producătorul ar trebui să acorde o atenție deosebită reducerii la minimum a riscului de contaminare încrucișată. Proiectarea echipamentelor și a spațiilor, metodele de testare și control, precum și limitele pentru concentrațiile admisibile de reziduuri după curățare trebuie să țină cont de natura acestor riscuri. Acolo unde este cazul, producătorul trebuie să acorde atenție organizării muncii în cicluri de producție (campanii). Atunci când alegeți un detergent, trebuie luată în considerare solubilitatea medicamentului pentru studiile clinice.
VI. DOCUMENTARE
Specificații și instrucțiuni
21. (6) Specificațiile (pentru materii prime, materiale de ambalare primară, produse intermediare, produse în vrac și produse finite), reglementările, instrucțiunile de proces și instrucțiunile de ambalare trebuie să fie atât de complete pe cât permite nivelul de cunoștințe existent despre produs. Pe măsură ce dezvoltarea medicamentelor progresează, acestea ar trebui să fie evaluate și actualizate periodic (dacă este necesar). Fiecare versiune nouă trebuie să țină cont de cele mai recente date, tehnologie utilizată în prezent, cerințeFarmacopeea de statale Federației Ruse și actele juridice de reglementare ale Federației Ruse. Versiune nouă ar trebui să conțină, de asemenea, un link către versiunea anterioară pentru a asigura trasabilitatea modificărilor. Producătorul trebuie să stabilească o procedură pentru efectuarea oricăror modificări care pot afecta calitatea medicamentului experimental, în special stabilitatea și bioechivalența acestuia.
22. (7) Justificarea modificărilor trebuie să fie documentată. Producătorul trebuie să analizeze impactul modificărilor aduse asupra calității medicamentului experimental și asupra studiilor clinice în curs. Rezultatele unei astfel de analize trebuie documentate.
Comanda
23. (8) Comanda trebuie să conțină o cerință pentru producerea și (sau) ambalarea unui anumit număr de unități de produs și (sau) expedierea acestuia. Comanda către producător este trimisă de sponsor sau de o persoană care acționează în numele acestuia. Comanda trebuie plasată pe hârtie și (sau) în formular electronicși să fie suficient de clar pentru a evita neînțelegerile. Ordinul trebuie să fie aprobat de o persoană cu autoritatea corespunzătoare și să includă o trimitere la dosarul medicamentului și la protocolul studiului clinic.
Dosar de droguri
24. (9) Dosarul pentru un medicament trebuie să fie actualizat continuu pe măsură ce medicamentul este dezvoltat. În același timp, producătorul trebuie să asigure trasabilitatea versiunilor anterioare ale dosarului medicamentului.
25. Dosarul pentru un medicament trebuie să includă, în special, următoarele documente (sau să conțină link-uri către acestea):
specificații și metode analitice pentru materii prime și materiale de ambalare;
specificații și metode analitice pentru produse intermediare, vrac și finite;
instructiuni tehnologice;
metode de control în timpul procesului de producție;
o copie aprobată a etichetei;
protocoale de studii clinice și, după caz, coduri de randomizare;
contracte cu artiştii executanţi specificati la paragrafele 237 - 255 aceste Reguli (dacă este necesar);
date de stabilitate;
conditii de depozitare si transport.
26. Lista de documente de mai sus poate varia în funcție de medicament și de stadiul dezvoltării acestuia. Informațiile conținute în dosar ar trebui să servească drept bază pentru evaluarea gradului de pregătire pentru acceptarea și eliberarea unui anumit lot de către o persoană autorizată care ar trebui să aibă acces la astfel de informații. Dacă se desfășoară diferite etape ale procesului de producție în zone diferite în care sunt responsabile diferite persoane autorizate, este permisă menținerea unor fișiere separate cu informații limitate relevante pentru activitățile din zonele respective.
Acest text poate fi editat în panoul de administrare din secțiunea „Texte”.
Ordinul Ministerului Industriei și Comerțului al Federației Ruse din 14 iunie 2013 N 916
- Ordinul Ministerului Industriei și Comerțului al Federației Ruse din 14 iunie 2013 N 916 „Cu privire la aprobarea Regulilor de organizare a producției și controlului calității medicamentelor”
Înregistrat la Ministerul Justiției al Federației Ruse la 10 septembrie 2013 Nr. de înregistrare 29938În conformitate cu partea 1 a articolului 45 Legea federală din 12 aprilie 2010 N 61-FZ „Cu privire la circulația medicamentelor” (Legislația colectată a Federației Ruse, 2010, N 16, Art. 1815, N 26, Art. 3446) și subclauza 5.2.18.31 din clauza 5 din Reglementări privind Ministerul Industriei și Comerțului al Federației Ruse, aprobate prin Decretul Guvernului Federației Ruse din 5 iunie 2008 N 438 (Colectarea Legislației Federației Ruse, 2008, N 42, Art. 4825; 2009, N 3, Art. 378, N. 11, Art. 3197, Art. 4251 4574, Art. 5854, Art. 5886;
1. Aprobați Regulile anexate de organizare a producției și controlul calității medicamentelor.
2. Îmi rezerv controlul asupra executării acestui ordin.
Reguli de organizare a producției și controlului calității medicamentelor (aprobat prin ordin al Ministerului Industriei și Comerțului al Federației Ruse din 14 iunie 2013 N 916)
I. Dispoziţii generale
II. Termeni și definiții
III. Cerințe de bază pentru organizarea producției și controlul calității medicamentelor
IV. Cerințe de bază pentru substanțele farmaceutice utilizate ca materii prime
- Introducere (1)
- Managementul calitatii (2)
- personal (3)
- Clădiri și spații (4)
- Echipamente tehnologice (5)
- Documentație și înregistrări (6)
- Lucrul cu materii prime (7)
- Proces tehnologic și control în timpul producției (8)
- Ambalarea și marcarea de identificare a substanțelor farmaceutice și a produselor intermediare (9)
- Depozitare și vânzare (10)
- Control de laborator (11)
- Validare (12)
- Modificare control (13)
- Respingerea și reutilizarea materialelor (14)
- Reclamații și recenzii (15)
- Contract de fabricație (inclusiv laboratoare) (16)
- Organizații care efectuează reambalarea și (sau) reetichetarea (17)
- Orientări speciale privind substanțele farmaceutice produse prin cultură celulară sau fermentație (18)
- Substanțe farmaceutice destinate studiilor clinice (19)
- Termeni și definiții (20)
Anexe la Regulile de organizare a producției și controlului calității medicamentelor
Anexa nr. 1 Producția de medicamente sterile
- I. Principiul
- II. Cerințe generale
- III. Clasificarea camerelor curate și a zonelor curate
- IV. Monitorizarea camerelor curate și a zonelor curate
- V. Tehnologia de izolare
- VI. Tehnologia blow-fill-seal
- VII. Produse supuse sterilizării terminale
- VIII. Producția aseptică
- IX. Personal
- X. Localuri
- XI. Echipament / XII. Salubritate
- XIII. Proces
- XIV. Sterilizarea
- XV. Sterilizare termică / XVI. Sterilizarea cu abur
- XVII. Sterilizare la căldură uscată / XVIII. Sterilizarea prin radiații
- XIX. Sterilizarea cu oxid de etilenă
- XX. Filtrarea medicamentelor care nu pot fi sterilizate în ambalajul final
- XXI. Finalizarea procesului de fabricare a produsului steril
- XXII. Controlul calității
Anexa nr. 2 Producția de substanțe și medicamente biologice (inclusiv imunobiologice)
- I. Domeniul de aplicare
- II. Principiu
- III. Ghid general (partea A)
- IV. Îndrumări specifice pentru anumite tipuri de produse (Partea B)
- V. Termeni și definiții
Anexa nr. 3 Producția de radiofarmaceutice
- I. Principiul
- II. Introducere
- III. Asigurarea calitatii / IV. Personal
- V. Spații și echipamente
- VI. Documentare / VII. Productie
- VIII. Controlul calității
- IX. Mostre de control și arhivă / X. Implementare / XI. Termeni și definiții
Anexa nr. 4 Caracteristici ale producției de medicamente de uz veterinar (cu excepția medicamentelor imunobiologice de uz veterinar)
Anexa nr. 5 Caracteristici ale producției de medicamente imunobiologice de uz veterinar
Anexa nr. 6 Producerea gazelor medicale
- I. Principiul
- II. Producția de gaze ca substanțe farmaceutice
- III. Producerea gazelor medicale
- IV. Termeni și definiții
Anexa nr. 7 Producerea preparatelor medicinale din plante
- I. Principiul
- II. Spații și echipamente
- III. Documentare
- IV. Controlul calității
Anexa Nr. 8 Eșantionarea materiilor prime și a materialelor de ambalare
- Textul aplicației
Anexa nr. 9 Producția de lichide, creme și unguente
- Textul aplicației
Anexa nr. 10 Producerea de medicamente în aerosoli în doză măsurată sub presiune pentru inhalare
- Textul aplicației
Anexa nr. 11 Sisteme computerizate
- I. Principiul
- II. Cerințe generale
- III. Etapa proiectului
- IV. Etapa de operare
- V. Termeni și definiții
Anexa nr. 12 Utilizarea radiaţiilor ionizante în producerea medicamentelor
- I. Introducere
- II. Responsabilitate / III. Dozimetrie
- IV. Validarea procesului
- V. Punerea în funcţiune a centralei
- VI. Sediul
- VII. Proces
- VIII. Documentare
- IX. Control microbiologic
Anexa nr. 13 Medicamente pentru studii clinice
- I. Principiul
- II. Termeni și definiții
- III. Managementul calitatii / IV. Personal / V. Spații și echipamente
- VI. Documentare
- VII. Productie
- VIII. Controlul calității
- IX. Eliberarea permisiunii de a lansa seriale
- X. Transporturi / XI. Revendicări
- XII. Recenzii și retururi / XIII. Distrugere
Anexa nr. 14 Producția de medicamente obținute din sânge sau plasmă donată
- I. Termeni și definiții
- II. Zona de aplicare (1)
- III. Principii (2)
- IV. Managementul calitatii (3)
- V. Trasabilitate și activități desfășurate după recoltarea sângelui (4)
- VI. Spații și echipamente (5)
- VII. Producție (6)
- VIII. Controlul calitatii (7) / IX. Eliberarea autorizației de eliberare a produselor intermediare și finite (8) / X. Depozitarea probelor de bazin de plasmă (9) / XI. Eliminarea deșeurilor (10)
Anexa nr. 15 Calificare și validare
- I. Principiul / II. Planificarea validării
- III. Documentatie / IV. Calificare
- V. Validarea procesului
- VI. Validarea curățeniei / VII. Schimbați controlul
- VIII. Revalidare / IX. Termeni și definiții
Anexa nr. 16 Confirmarea de către o persoană autorizată a conformității unei serii de produse în scopul eliberării acesteia
- I. Domeniul de aplicare / II. Principiu
- III. Introducere
- IV. Cerințe generale
- V. Testarea și lansarea unei serii de produse fabricate în Federația Rusă
- VI. Responsabilitățile unei persoane autorizate
- VII. Termeni și definiții
Anexa nr. 17 Eliberare prin parametri
- I. Principiul / II. Eliberare conform parametrilor / III. Eliberare prin parametri pentru produse sterile
- IV. Termeni și definiții
Anexa nr. 18 Probele de control și de arhivă
- I. Domeniul de aplicare
- II. Principiu
- III. Durata de depozitare / IV. Numărul de probe de control și de arhivă
- V. Condiții de depozitare / VI. Acorduri
- VII. Probele de control. Prevederi generale
- VIII. Mostre de arhivă. Prevederi generale
Serviciul Federal de Supraveghere Veterinară și Fitosanitară
Această secțiune conține versiuni actuale ale actelor juridice de reglementare (legi, ordine, decrete, decizii Curtea Supremă de Justiție RF etc.), de interes pentru specialiştii din domeniul medicinei veterinare şi fitosanitare.
Puteți obține informații suplimentare punând o întrebare în secțiunea „Recepție electronică”.
Ordinul Ministerului Industriei și Comerțului din Rusia din 14 iunie 2013 nr. 916
„Cu privire la aprobarea regulilor de organizare a producției și controlului calității medicamentelor”
Regulile de organizare a producției și controlului calității medicamentelor intră în vigoare la 10 zile de la data publicării lor oficiale.
Medicamente, Ministerul Industriei și Comerțului, Ordin
Ordinul Ministerului Industriei si Comertului 916 din 14062013
- Ordinul Ministerului Industriei și Comerțului al Federației Ruse din 14 iunie 2013
Ordinul Ministerului Industriei și Comerțului al Federației Ruse din 14 iunie 2013 nr. 916 „Cu privire la aprobarea Regulilor de organizare a producției și controlului calității medicamentelor”
Înregistrat la Ministerul Justiției al Federației Ruse la 10 septembrie 2013 Nr. de înregistrare 29938
În conformitate cu partea 1 a articolului 45 din Legea federală din 12 aprilie 2010 nr. 61-FZ „Cu privire la circulația medicamentelor” (Legislația colectată a Federației Ruse, 2010, nr. 16, art. 1815, nr. 26 , Art. 3446) și subclauza 5.2 .18.31 clauza 5 din Regulamentul Ministerului Industriei și Comerțului al Federației Ruse, aprobat prin Decretul Guvernului Federației Ruse din 5 iunie 2008 Nr. 438 (Legislația Federația Rusă, 2008, nr. 378, nr. 3065, nr , nr. 960 , art. 3351, nr. 43, art. 192, nr.
1. Aprobați Regulile anexate de organizare a producției și controlul calității medicamentelor.
2. Îmi rezerv controlul asupra executării acestui ordin.
Denis Manturov: Cererea de arme rusești în lume este în continuă creștere
Denis Manturov: Pentru majoritatea rușilor, calitatea produselor este mai importantă decât prețul
Software, oameni sau hardware? Interviu cu Denis Manturov în urma rezultatelor Innoprom-2018
Denis Manturov: Întreprinderile vor fi rambursate pentru TVA dacă își exportă produsele
Cu privire la modificările aduse componenței comisiei de certificare a șefilor guvernului federal întreprinderi unitare, care sunt sub jurisdicția Ministerului Industriei și Comerțului al Federației Ruse, precum și competențele fondatorului și proprietarului proprietății ale cărora sunt exercitate de statul federal institutie bugetara„Centrul Național de Cercetare „Institutul numit după N.E. Jukovski”, aprobat prin ordin al Ministerului Industriei și Comerțului al Federației Ruse din 20 octombrie 2016 Nr. 3729
Cu privire la modificările la ordinul Ministerului Industriei și Comerțului al Federației Ruse din 26 octombrie 2016 nr. 3806
Cadrul legislativ al Federației Ruse
Consultație gratuită
Legislația federală
- Acasă
- ORDIN al Ministerului Industriei și Comerțului al Federației Ruse din 14 iunie 2013 N 916 „PRIVĂ APROBAREA REGULUI DE ORGANIZAREA PRODUCȚIEI ȘI CONTROLULUI CALITĂȚII MEDICAMENTULUI”
- La momentul includerii în baza de date, documentul nu a fost publicat
- accesul la care este asigurat pe Site numai abonaților;
- orice materiale publicate în versiunea tipărită a ziarului și care conțin marca „Publicat în numărul ziarului”;
- toate materialele de pe Site reproduse în orice alt mod decât distribuția pe Internet.
DOCUMENTAȚIE ȘI ÎNREGISTRE (6)
375. (6.10) Toate documentele legate de producerea de intermediari sau API trebuie să fie compilate, revizuite, aprobate și distribuite în conformitate cu procedurile aprobate de producător. Astfel de documente pot fi emise atât în formă scrisă, cât și în formă electronică.
376. (6.11) Eliberarea, revizuirea, înlocuirea sau retragerea tuturor documentației trebuie controlată, păstrând informații despre versiunile anterioare ale acestora.
377. (6.12) Producătorul trebuie să stabilească un sistem pentru stocarea tuturor documentelor (de exemplu, rapoarte de dezvoltare, rapoarte de extindere, rapoarte de transfer de tehnologie, rapoarte de validare a proceselor, înregistrări de instruire, înregistrări de producție, documente de inspecție și înregistrări de implementare) cu indicarea perioadelor de depozitare. pentru astfel de documente.
378. (6.13) Toate evidențele de producție, control și vânzări trebuie păstrate cel puțin 1 an de la data expirării lotului. Înregistrările care conțin date din testele repetate ale produsului farmaceutic trebuie păstrate timp de cel puțin 3 ani de la implementarea completă a seriei.
379. (6.14) Înscrierile trebuie făcute cu cerneală de neșters în locurile special prevăzute pentru aceasta imediat după efectuarea operațiunilor; persoana care a făcut înregistrarea trebuie identificată. Corecțiile la înregistrări trebuie să fie semnate și datate. Asemenea corecții nu trebuie să împiedice citirea înregistrării în forma sa originală.
380. (6.15) În timpul perioadei de păstrare, originalele sau copiile înregistrărilor trebuie să fie ușor disponibile la locul de muncă unde a fost efectuată munca descrisă în înregistrări. De asemenea, este posibil să obțineți rapid înregistrări din alte locații de stocare prin mijloace electronice sau alte mijloace.
381. (6.16) Specificațiile, instrucțiunile, procedurile și înregistrările pot fi păstrate fie în original, fie sub formă de copii, cum ar fi fotocopii, microfilme, microfișe sau alte forme de reproducere fidelă a înregistrărilor originale. Dacă s-au folosit tehnici originale de reducere, cum ar fi microfilmarea sau înregistrarea electronică, trebuie să fie disponibil echipament adecvat de citire, precum și facilități pentru realizarea de copii pe hârtie.
382. (6.17) Producătorul trebuie să elaboreze și să documenteze specificațiile pentru materiile prime, intermediarii (dacă este necesar), API-urile și materialele de etichetare și ambalare. În plus, pot fi necesare specificații pentru anumite alte materiale (de exemplu, materiale auxiliare, garnituri) utilizate în timpul producției de intermediari sau API care pot fi critice pentru calitate. Trebuie stabilite și documentate criteriile de acceptare pentru inspecție în timpul producției.
383. (6.18) Dacă este folosit semnături electronice pe documente, acestea trebuie identificate și protejate.
384. (6.20) În evidențele de utilizare, curățare, igienizareși (sau) sterilizare, precum și întreţinere a echipamentului principal trebuie indicate data, ora (daca este necesar), denumirea produsului, numarul fiecarui lot de produse produse pe acest echipament, precum si persoana care a efectuat curatenia si intretinerea.
385. (6.21) Nu este nevoie de pregătire înregistrări individuale curățarea și utilizarea echipamentului dacă este conceput special pentru producerea unei denumiri de intermediar sau API și loturile din acel intermediar sau API sunt produse într-o secvență trasabilă. În cazul în care se utilizează echipamente special concepute, înregistrările privind curățarea, întreținerea și funcționarea acestuia pot fi fie parte din fișierul lotului, fie un document separat.
386. (6.30) Este necesar să se țină evidențe pentru materiile prime, produsele intermediare, materialele de ambalare, materialele pentru etichetarea substanțelor farmaceutice, care să cuprindă următoarele date:
denumirea producătorului, identificarea și cantitatea fiecărui transport din fiecare lot de materii prime, produse intermediare sau materiale de ambalare și materiale pentru etichetarea substanțelor medicamentoase;
numele furnizorului; numerele de control al furnizorului (dacă se cunosc) sau alt număr de identificare; numărul atribuit la acceptare și data acceptării;
rezultatele tuturor încercărilor sau inspecțiilor efectuate și concluziile desprinse din acestea;
înregistrări care urmăresc utilizarea materialelor;
documentația privind evaluarea și verificarea materialelor de ambalare și a materialelor pentru etichetarea substanțelor medicamentoase pentru conformitatea cu specificațiile stabilite;
decizie finală privind materiile prime, produsele intermediare sau materialele de ambalare și etichetare respinse pentru substanțele medicamentoase.
387. (6.31) Producătorul trebuie să păstreze mostre aprobate de etichete pentru comparare cu etichetele produse.
388. (6.40) Pentru a asigura uniformitatea de la lot la lot, producătorul trebuie să elaboreze reglementări industriale pentru fiecare tip de substanță farmaceutică, care sunt aprobate de șeful producătorului și, de asemenea, verificate independent și semnate și datate de o persoană din calitatea sa. departament. Pe baza reglementărilor industriale, sunt elaborate instrucțiuni tehnologice pentru fiecare etapă a procesului tehnologic și (sau) pentru fiecare tip de produs intermediar, care sunt semnate de o persoană cu o dată și, de asemenea, verificate și semnate independent de o persoană din departamentul de calitate. cu o întâlnire. Reglementările industriale includ o listă a materialelor utilizate, indicând cantitatea fiecăruia dintre acestea, date despre echipamentele utilizate, o descriere a procesului tehnologic și metode de control în toate etapele producției farmaceutice. Cerințele generale pentru structură și alte cerințe pentru conținutul reglementărilor industriale sunt stabilite prin actele juridice de reglementare relevante ale Federației Ruse.
389. (6.41) Instrucțiunile tehnologice ar trebui să includă:
denumirea produsului intermediar produs sau a substanței farmaceutice și stadiul procesului tehnologic, precum și, dacă este cazul, codul documentului corespunzător;
o listă completă a materiilor prime și a produselor intermediare, cu denumiri sau coduri suficient de specifice pentru a permite identificarea și determinarea oricăror caracteristici speciale de calitate;
o indicare exactă a cantității sau raportului fiecărui articol de materie primă sau produs intermediar utilizat, indicând unitățile de măsură. Dacă această cantitate nu este fixă, atunci este necesar să se furnizeze un calcul pentru fiecare dimensiune a lotului sau mod de proces. De asemenea, este necesară indicarea abaterilor de la cantitățile specificate, dacă acestea sunt justificate;
locația procesului tehnologic și principalul echipament tehnologic care este utilizat;
acțiuni tehnologice detaliate, inclusiv:
succesiunea care trebuie urmată;
intervalele de parametri de proces utilizate;
instrucțiuni de prelevare și monitorizare în timpul producției, indicând criteriile de acceptare acolo unde este necesar;
termenele limită pentru finalizarea etapelor individuale ale procesului tehnologic și (sau) întregului proces în ansamblu, atunci când este necesar;
intervalele de randament așteptate la etapele sau perioadele relevante ale procesului;
instrucțiuni și precauții speciale care trebuie respectate sau trimiteri încrucișate corespunzătoare la acestea, dacă este necesar;
instrucțiuni pentru depozitarea intermediarilor sau a substanțelor farmaceutice pentru a asigura adecvarea lor pentru utilizare, inclusiv material de ambalareși material de marcare, precum și conditii speciale depozitare, indicând perioadele atunci când este cazul.
390. (6.50) Pentru fiecare intermediar și API, trebuie pregătit un dosar de lot, inclusiv informatii complete despre producția și controlul calității fiecărei serii. Formularul eliberat pentru realizarea evidenței producției trebuie să respecte instrucțiunile tehnologice și să fie versiunea actuală. Dacă formularul de înscriere pentru producerea unei serii este întocmit pe baza unei părți separate a instrucțiunilor tehnologice, atunci un astfel de document trebuie să conțină un link către instrucțiunile tehnologice curente utilizate.
391. (6.51) Formularele de înregistrare trebuie numerotate cu un anumit număr de serie sau numărul de identificareși, de asemenea, semnat și datat la emitere. În producția continuă, codul produsului și data și ora lansării pot servi ca identificatori unici până când este atribuit un număr final de lot.
392. (6.52) Dosarul lotului (înregistrările producției și controlului calității) produselor după finalizarea fiecărei etape tehnologice importante trebuie să includă următoarele informații:
data și, după caz, ora;
principalele echipamente utilizate (de exemplu, reactoare, uscători, mori);
identificarea specifică a fiecărui lot, inclusiv masa, unitățile de măsură, numerele de lot de materii prime, produse intermediare sau orice materiale reprocesate în timpul producției;
rezultate reale înregistrate ale parametrilor critici de proces;
detalii despre orice prelevare efectuată;
semnăturile persoanelor care au efectuat fiecare etapă critică a lucrării, precum și ale celor care au efectuat supraveghere sau inspecție directă;
rezultatele testelor în timpul producției și testelor de laborator;
ieșirea efectivă la etapele corespunzătoare sau la momente specifice;
descrierea ambalajelor și etichetării produselor intermediare sau substanțelor farmaceutice;
etichetă de probă pentru API sau intermediari, dacă sunt produse pentru vânzare;
orice abatere observată, evaluarea acesteia, informații despre investigația efectuată (dacă este necesar) sau o legătură către o astfel de investigație, dacă documentele relevante sunt păstrate separat;
rezultatele controlului la eliberarea permisului de eliberare.
393. (6.53) Producătorul trebuie să stabilească și să valideze procedurile care trebuie urmate atunci când se investighează abaterile critice sau când loturile de intermediari sau API nu sunt conforme cu specificațiile acestora. O astfel de investigație ar trebui să se extindă la alte loturi pentru care discrepanțele sau abaterile ar putea fi relevante.
394. (6.60) Documentele de control de laborator trebuie să includă detalii complete ale datelor obținute din toate testele efectuate pentru a demonstra conformitatea cu specificațiile stabilite și monografia farmacopeei generale, monografia farmacopeei, documentație de reglementare sau document de reglementare, inclusiv cercetări și determinări cantitative, și anume:
o descriere a probelor primite pentru testare, inclusiv denumirea materiei prime, locul prelevării, numărul lotului sau alt cod caracteristic, data prelevării și, după caz, cantitatea de eșantion prezentată pentru testare și data la care a fost primită;
o descriere a fiecărei metode de testare utilizate sau o referință la o astfel de metodă;
o indicație a masei probei sau a altor unități de măsură pentru proba utilizată pentru fiecare test, în conformitate cu metoda descrisă; date privind prepararea și testarea probelor standard, reactivilor și soluțiilor standard sau referințe încrucișate corespunzătoare;
înregistrări complete ale tuturor datelor brute obținute în timpul fiecărui test, în plus față de graficele, tabelele și spectrele obținute cu ajutorul instrumentelor de laborator, identificate corespunzător pentru substanța și lotul specific testat;
înregistrările tuturor calculelor efectuate în legătură cu testul, inclusiv unitățile de măsură, factorii de conversie și factorii de echivalență;
o declarație a rezultatelor testelor și conformitatea acestora cu criteriile de acceptare stabilite;
semnătura persoanei care a efectuat fiecare test și data (date) testului;
data și semnătura unei persoane care certifică că înregistrările originale au fost examinate pentru acuratețe, completitudine și conformitate.
395. (6.61) Trebuie păstrate, de asemenea, înregistrări complete care să indice:
orice modificare a procedurilor analitice stabilite;
calibrarea periodică a echipamentelor de laborator, aparatelor, instrumentelor de măsură și dispozitivelor de înregistrare;
toate testele FS pentru stabilitate;
investigarea abaterilor de la specificaţii.
396. (6.70) Pentru a determina conformitatea intermediarilor sau a API-urilor cu specificațiile stabilite înainte ca un lot să fie eliberat sau comercializat, trebuie stabilite proceduri de urmat pentru revizuirea și aprobarea producției loturilor și a înregistrărilor de control de laborator, inclusiv ambalarea și etichetarea.
397. (6.71) Înregistrările privind producerea loturilor și controlul de laborator al etapelor critice ale procesului sunt supuse verificării și confirmării de către unitatea (unitățile) de calitate înainte de eliberarea autorizației de eliberare sau înainte de vânzarea fiecărui lot de produs farmaceutic. Înregistrările de producție și de control de laborator pentru etapele necritice ale procesului pot fi revizuite de personal calificat din departamentul de producție sau din alte departamente în conformitate cu procedurile aprobate de departamentul (departamentele) calitate.
398. (6.72) Toate abaterile, rapoartele de investigație și abaterile de la specificații trebuie evaluate în timpul procesului de revizuire a dosarului lotului înainte de emiterea eliberării lotului.
399. (6.73) Unitatea sau unitățile de calitate pot delega unității de producție responsabilitățile și autoritatea de a autoriza utilizarea produselor intermediare, cu excepția cazului în care produsul este destinat a fi furnizat în afara controlului producătorului.
Adoptat: 14 iunie 2013 (N 916 din 14 iunie 2013)
Reproducerea materialelor este permisă numai sub rezerva restricțiilor stabilite de Deținătorul drepturilor de autor, indicând autorul materialelor utilizate și un link către „Vestnik farmaceutic” ca sursă de împrumut, cu un hyperlink obligatoriu către site-ul www.pharmvestnik.ru .
Restricții și interdicții privind reproducerea materialelor de pe Site:
1. Materiale postate pe site-ul www.pharmvestnik.ru (denumit în continuare „Site-ul”), pentru care Deținătorul drepturilor de autor a stabilit restricții privind reproducerea liberă:
Utilizarea materialelor care fac obiectul acestor restricții necesită acordul scris al Deținătorului drepturilor de autor - Bionica Media LLC.
- reproducerea materialelor altor deținători de drepturi de autor (utilizatorul trebuie să rezolve problemele de distribuție legală a unor astfel de materiale fără implicarea Bionica Media LLC);
- utilizarea extraselor din materiale în care contextul se schimbă, extrasele capătă un caracter ambiguu sau conotație disonantă, precum și orice prelucrare a materialului;
- utilizarea comercială a materialelor, de ex. utilizarea anumitor materiale (un fragment din acesta) selectate pe Site în scopul implementării comerciale a dreptului de acces la acest material sau a acordării unor drepturi asupra acestuia unor terți.
- Ordinul Ministerului Justiției al Federației Ruse din 16 iunie 2017 nr. 108 „Cu privire la modificările la formularele registrelor de înregistrare actiuni notariale, certificatele notariale, inscripțiile de certificare privind tranzacțiile și documentele certificate și procedura de întocmire a formularelor […]
- Ordinul nr. 477n din 4 mai 2012 Cu privire la aprobarea listei de condiții pentru care se acordă primul ajutor și a listei de măsuri pentru acordarea primului ajutor Înregistrată la Ministerul Justiției al Federației Ruse la 16 mai 2012 Număr de înregistrare 24183 În conformitate cu articolul 31 […]
- Amenzi pentru încălcarea rutierăîn Armenia În luna iunie a acestui an, opoziția din Armenia și-a prezentat autorităților cererile în 12 puncte, care priveau în principal îmbunătățirea condiţiile sociale cetăţenii. Printre acestea, un punct separat impunea revizuirea actualului […]
- Ordinul Ministerului Afacerilor Interne al Federației Ruse din 27 aprilie 2012 N 373 „În aprobare Reglementări administrative Ministerul Afacerilor Interne al Federației Ruse să ofere servicii publice pentru eliberarea unui permis unui cetățean al Federației Ruse pentru a depozita și transporta […]
- Efectuarea certificării la locul de muncă Întrebare: Bună ziua. În februarie 2013, certificarea la locul de muncă a fost anulată pentru companiile care au doar birouri. Am informații contradictorii: unii avocați îmi spun că certificarea la locul de muncă ar trebui efectuată [...]
- Decretul Guvernului Federației Ruse din 16 august 2013 N 712 „Cu privire la procedura de certificare a deșeurilor din clasele de pericol I - IV” Decretul Guvernului Federației Ruse din 16 august 2013 N 712 „Cu privire la procedura de certificarea deșeurilor din clasele de pericol I - IV" Despre […]
- bogorodsky-shchelkovo.rf Forum pentru locuitorii microdistrictului Bogorodsky, Shchelkovo Rambursarea taxelor la cumpărarea unei case Accesați pagina: Mesaj Matvey » 27 martie 2015, 10:26 Re: Rambursarea taxelor la cumpărarea unei case Mesaj svv777 » 12 mai 2015, 21: 32 R2D2 […]
Ordinul Ministerului Industriei și Comerțului din Rusia F N 916 din 14 iunie 2013
Data adoptării documentului: 14 iunie 2013
Detalii: N 916 din 14 iunie 2013
Ordinul Ministerului Industriei și Comerțului din Rusia F N 916 din 14 iunie 2013 „Cu privire la aprobarea Regulilor de organizare a producției și controlului calității medicamentelor”.